产品展示
多光子显微镜的最新发展 ——突破速度、视野和小型化的极限
- 来源:杏彩體育
- 添加时间: 2024-12-19 17:07:02
- 最近的生物学研究一直在向3D结构发展,在类器官、体外3D细胞培养和体内清醒动物研究领域取得了巨大
最近的生物学研究一直在向3D结构发展,在类器官、体外3D细胞培养和体内清醒动物研究领域取得了巨大
在多光子显微镜中,当两个或多个光子(几乎)同时被焦平面上的荧光团吸收时,会产生荧光,但要实现这一点,需要非常高的激发功率密度。因此,每台多光子显微镜的核心都是一台满足特别的条件的激光器。对于双光子显微镜,这些是短脉冲、高功率(但远低于DNA损伤的阈值)、高重复率和与荧光团峰值吸收截面相匹配的波长[2,3,4]。典型的激光器的脉冲维持的时间在75-150fs的范围内,在锁模状态下工作,重复率固定在50到100MHz之间,足够高以在像素内具有多个激发周期,但足够低以允许荧光团弛豫到基态(典型的激发态寿命在3到5ns之间)。荧光团的双光子激发波长范围为750 nm至1200 nm,与可调谐钛宝石激光器的范围以及最近开发的更紧凑的光纤激光器或光学参量振荡器(OPO)相匹配。关于这些之间的比较,请参见[5,6]。
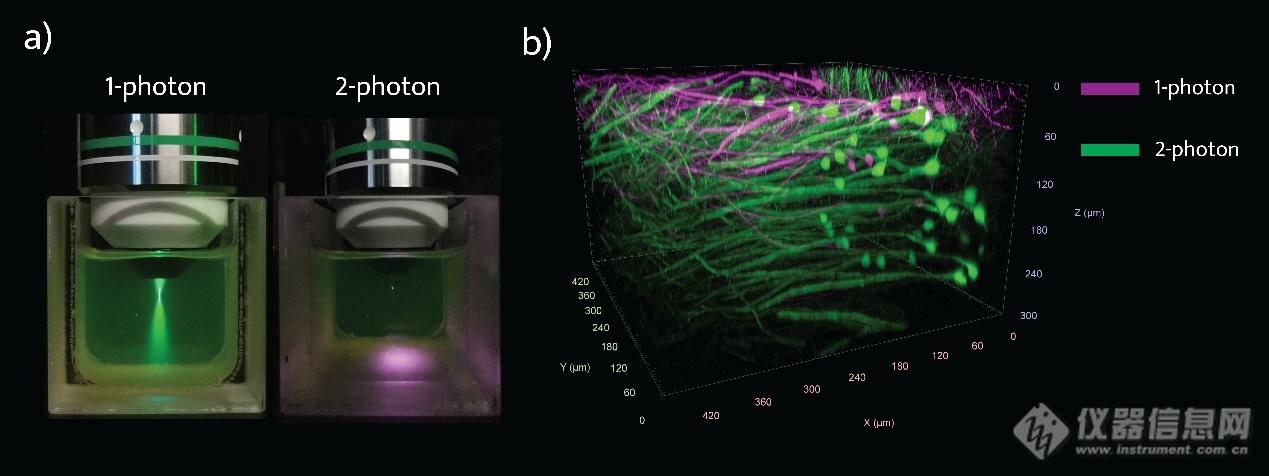
在标准多光子显微镜中,光束路径相对简单(图2)。x-y检流计扫描仪(电流计,或者为了更快的图像采集,共振电流计)将光束通过扫描透镜和管透镜移动到物镜的后孔径。在这里,能够最终靠略微填充后孔(更高的穿透深度)和过度填充(更高分辨率)来实现穿透深度和分辨率之间的权衡,以满足多种类型的样品和实验要求。非线性激发的固有光学切片能力意味着非退扫描检测路径足以在没有离焦光的情况下实现无背景图像。
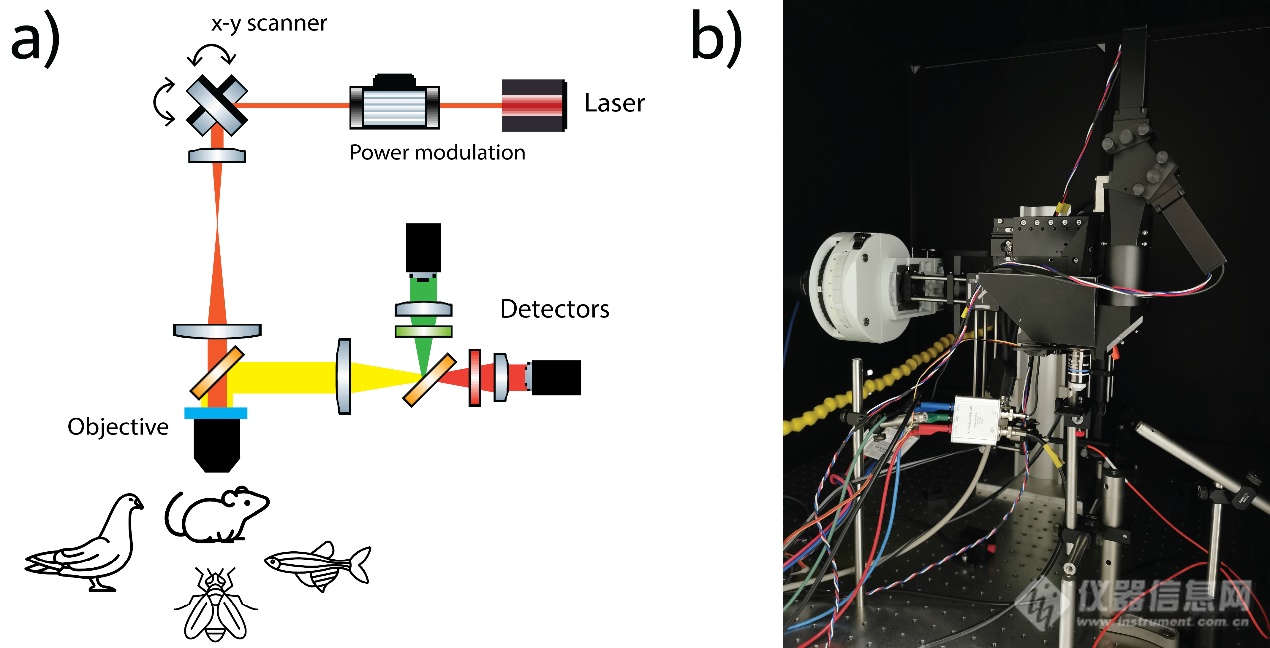
多光子显微镜的一个流行应用是通过活体大脑深处的钙指示剂对神经元活动进行成像[9]。最常用的指示剂是基因编码的GCaMP(gfp标记的钙调素),它一直在开发中,新版本比以前的更亮,响应和衰减时间更快[10,11]。为此,数据采集需要跟上生物学的步伐。作为一种光栅扫描技术,多光子显微镜本质上很慢。自从多光子显微镜的早期发展以来,许多研究都解决了这个问题。
使用微透镜阵列创建了多个光束,并在样品平面上同时扫描[12]。微透镜阵列也被旋转以实现225 Hz的成像[13],或与限制光束路径中传输损耗的衍射光学元件结合[14]。
最近,科学家们采用了时间聚焦的宽视场照明来消除点扫描的需要。该概念依赖于利用色散光学元件(如光栅)在光谱上分离激光脉冲来在时间和空间上对激光束进行整形。然后,光束的成分在物镜的焦平面处重新组合,脉冲达到最短维持的时间,功率密度足够高,可用于多光子吸收[15,16,17]。该技术不仅用于钙成像,还用于电压指示器成像,速度高达1 kHz[18]。
时间聚焦可用于将光雕刻成单个细胞的形状,并在焦平面上进行光栅扫描[19]。为了使光束沿轴向移动,研究人员有不同的策略。
最简单的方法是使用压电装置或压电体来移动样品台或物镜。图3显示了由于这种设备,在0.75Hz的频率下,美西钝口螈大脑200µm深处记录的体积神经元活动。将压电扫描与雕刻光相结合,研究人员能够以单细胞分辨率和3-6Hz的速率实现0.5mm×0.5mm×0.5mm的体积成像[20]。
另一种方法是远程聚焦。人类能在共轭样品平面上放置一个轻型镜子,并比重型物镜更快地扫描它[21]。
避免样品的机械扰动对于体内研究特别的重要,因为移动生物体会导致压力和结果偏差。与远程聚焦类似,随机存取多光子显微镜在所有三个维度上引导光束,而无需移动样品或物镜。由于声光偏转器或空间光调制器,人们也只能探测感兴趣的细胞,而不会对“空白空间”进行成像[22]。
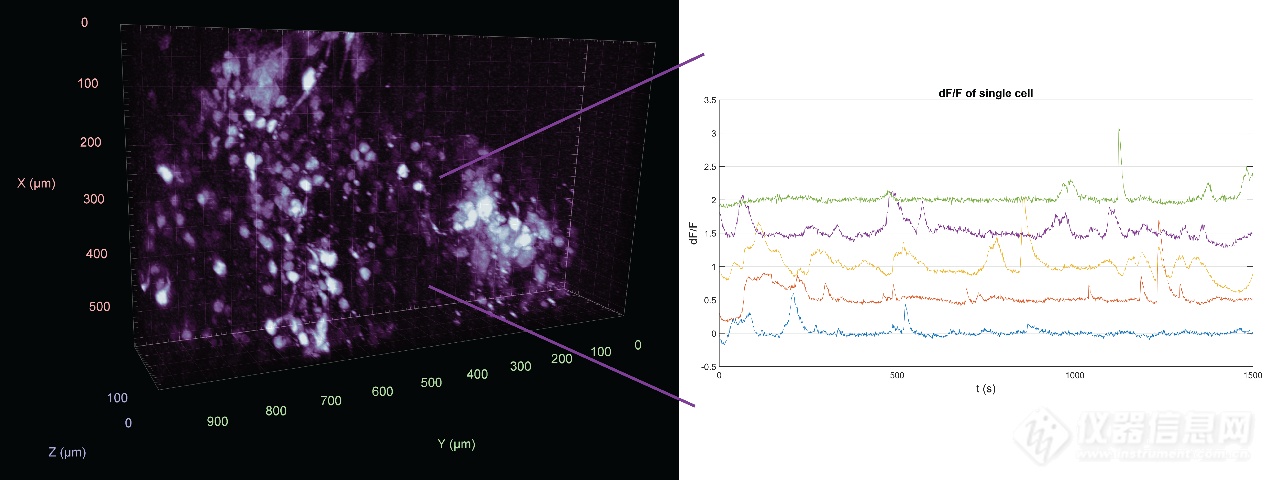
图3: 200µm深的蝾螈脑内GCaMP钙成像。以0.75 Hz的频率成像。
为了研究自由移动生物体的生物动力学,研究人员开发了微型多光子显微显微镜,能安装在活体动物感兴趣的区域顶部。在神经科学中,这通常是头部。飞秒脉冲通过空心光子晶体光纤传输。扫描是通过微机电系统(MEMS)扫描仪实现的。发射的光通过多模光纤收集,并由外部设备检测。尽管这一概念还处于起步阶段,但已经在自由行为的小鼠身上证明了其双光子成像[23]。使用MEMS压电设备做体积成像是可能的[24],研究人员甚至将该技术推向了3台头戴式显微镜[25]。
在3D环境中可视化动态生物过程对各种研究至关重要,从大规模探测细胞相互作用到药物发现和疾病研究。多光子显微镜提供固有的光学切片,能够给大家提供活体组织深处的大体积图像。
自20世纪90年代早期概念出现以来,显微镜界一直在开发新的技巧来提高速度、视野和分辨率,最近的工作证明了微型多光子显微镜的可能性。令人兴奋的新进展不断涌现,新的生物学发现等待着我们。
我还要感谢MPI生物智能中心的Stefanie Kiderlen和Danielle Paynter对本文的校对。这项工作得到了马克斯·普朗克学会的支持。

